С 1 января 2015 года Россия входит в Евразийский экономический союз (ЕАЭС), государствами-членами которого, на данный момент, так же являются Республика Армения (с 2015 г.), Республика Беларусь (с 2015 г.), Республика Казахстан (с 2015 г.) и Кыргызская Республика (с 2015 г.). Главное преимущество для производителей медицинских изделий в принадлежности к ЕАЭС заключается в однократной регистрации (в любом из государств-членов ЕАЭС) и последующей возможности реализации своих изделий как медицинских в странах-признания ЕАЭС.
Уже сейчас регистрация медицинских изделий в рамках ЕАЭС осуществляется в соответствии с Правилами регистрации и экспертизы безопасности, качества и эффективности медицинских изделий, утвержденными Решением Совета ЕАЭС от 12.02.2016 № 46. В настоящее время и по 31 декабря 2021 г. длится переходный период, позволяющий производителям медизделий подготовиться к грядущим изменениям и оформить регистрационные удостоверения на их изделия.
Регистрация мед. изделий является обязательной, т.к. одна из обязанностей надзирающих органов государств-членов – наблюдение за качеством и безопасностью медицинских товаров, которые продаются на рынке ЕАЭС. В обращение может поступить только та продукция, которая прошла обязательную регистрацию.
Самостоятельно разобраться во всех тонкостях действующего законодательства затруднительно даже для опытных специалистов, но уже сейчас для обращения медизделий на территории России (а в будущем – и на территории ЕАЭС) производителям доступна регистрация медизделий экспертами ООО «Юниверсал Право», в соответствии со всеми актуальными требованиями, в т.ч. по Правилам ЕАЭС.
Встречайте будущие требования во всеоружии и пользуйтесь преимуществами ЕАЭС — регистрируйтесь по Правилам ЕАЭС с ООО «Юниверсал Право».
Процедура регистрации
Сопровождение ООО «Юниверсал Право» любой регистрации медицинских изделий проводится поэтапно. Ниже мы детально опишем каждый из них:
- Заключение договора.
Перед заключением договора ООО «Юниверсал Право» проводит первичный анализ предоставленных документов производителя (уполномоченного представителя), для определения объема необходимых корректировок, вида необходимых испытаний и ориентировочного срока регистрации. - Подготовка первичного регистрационного досье.
Эксперты ООО «Юниверсал Право» осуществляют подробный анализ документации, предоставленной производителем (уполномоченным представителем), на соответствие нормативным требованиям.В случае необходимости сотрудники ООО «Юниверсал Право» осуществляют подготовку/корректировку проекта технической и эксплуатационной документации, необходимой для осуществления процесса регистрации на основании достоверных материалов, предоставленных производителем (уполномоченным представителем).
Внимание! Подготовка/корректировка документации осуществляется совместно с производителем (уполномоченным представителем) регистрируемого медицинских изделия.
- Проведение испытаний/исследований.
Эксперты ООО «Юниверсал Право» осуществляют сопровождение технических испытаний, исследований (испытаний) по оценке биологического действия, клинических исследований (испытаний) и испытания на утверждение типа средств измерений в аккредитованных в системе ЕАЭС испытательных центрах.Для иностранных производителей медицинских изделий наши эксперты содействуют оформлению разрешения на ввоз в Росздравнадзоре, ввоза образцов изделий на территорию Российской Федерации с целью проведения технических и прочих испытаний (исследований).
Отличие регистрации медицинского изделия в рамках ЕАЭС от привычной процедуры регистрации в рамках национальной системы в одноэтапности регистрации, вне зависимости от класса опасности. Разрешение на клинические испытания оформляется в случае недостаточности документальных доказательств для подтверждения функциональной безопасности медизделия в процессе клинических исследований, и, соответственно, требуются фактические клинические испытания (с участием пациентов).
По итогу испытаний (исследований) сотрудники ООО «Юниверсал Право» совместно с производителем (уполномоченным представителем) согласовывают выявленные в процессе испытаний/исследований дополнения и уточнения документов регистрационного досье.
- Сбор регистрационного досье.
Перед подачей регистрационного досье сотрудники ООО «Юниверсал Право» консультируют производителя (уполномоченного представителя) о правилах заверения документации и производят завершающий анализ регистрационного досье. - Экспертиза государства-референта.
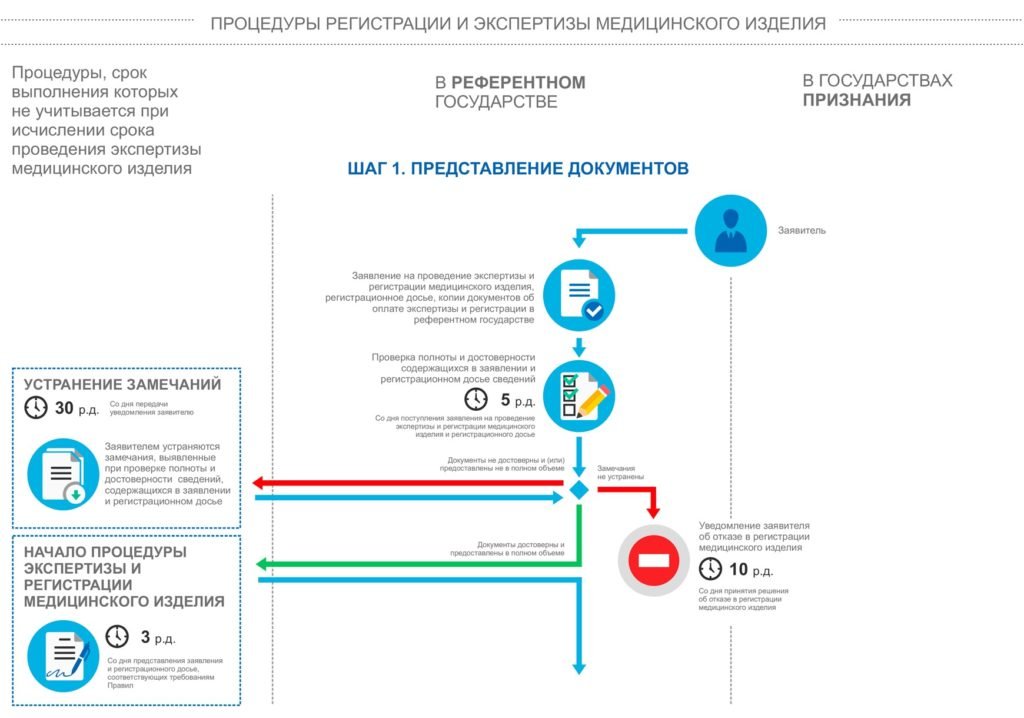
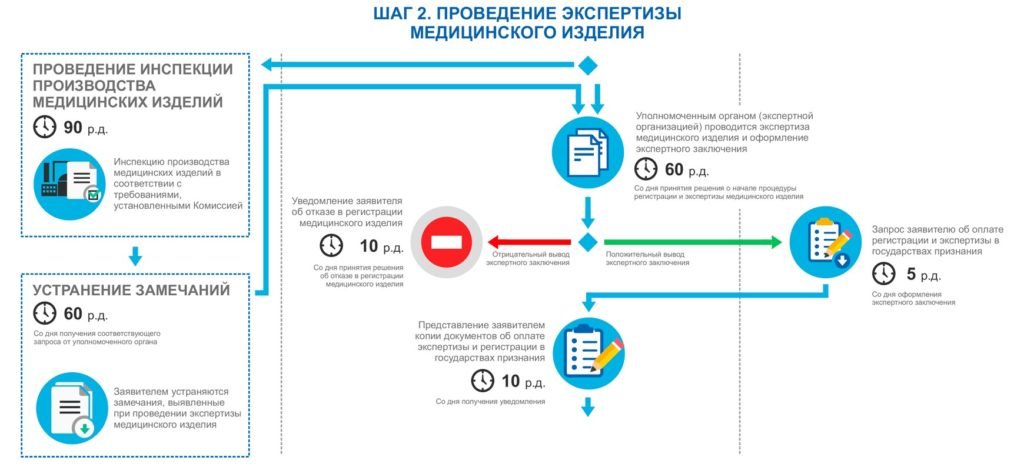
После окончательного формирования регистрационного досье, документацию сдают в уполномоченный орган государства-референта, для Российской Федерации – Росздравнадзор. Досье получает собственный уникальный номер, по которому его можно отслеживать в режиме онлайн.Процесс экспертизы проводится сотрудниками уполномоченного органа государства-референта (для Российской Федерации – Росздравнадзор) и экспертной организацией (для Российской Федерации – ФГБУ «ВНИИИМТ» или ФГБУ «Национальный Институт Качества»).
При необходимости специалисты ООО «Юниверсал Право» предоставляют экспертной организации дополнительные материалы касательно регистрируемых изделий, а также отвечают на их запросы. В целом, ООО «Юниверсал Право» контролирует весь процесс экспертизы на данном этапе.
Во время данного этапа Росздравнадзор выдаёт разрешение на проведение инспекционного контроля на месте производства медицинского изделия.
Внимание! Для классов опасности «1» и «2а, нестерильные медицинские изделия» инспекционный контроль является добровольным.
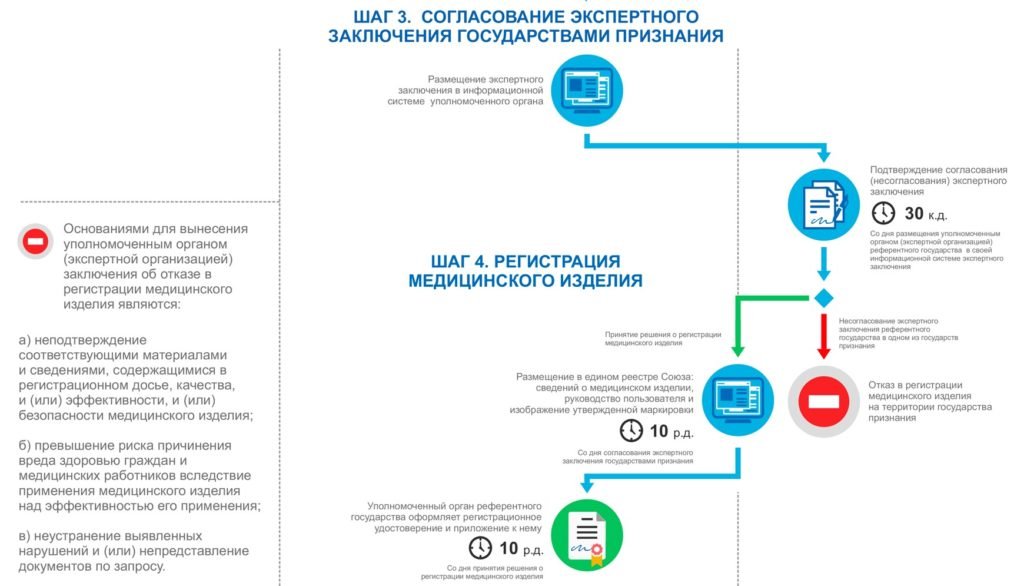
- Согласование регистрационного досье.
Согласование регистрационного досье происходит между государствами-признания, сотрудники уполномоченного органа государства-референта самостоятельно отправляют регистрационное досье медицинского изделия в органы (организации) стран признания, ответственные за осуществление регистрации, на согласование и распространение регистрационного удостоверения медицинского изделия в указанных странах. - Последний этап.
Внесение медицинского изделия в единый Единый реестр медицинских изделий, зарегистрированных в рамках ЕАЭС, и следующая за этим выдача Регистрационного удостоверения на это изделие, с указанием стран-признания, в которых медицинское изделие может обращаться. По завершению данного этапа медицинский товар становится полностью готовым к распространению на территории стран признания ЕАЭС.
Сроки и цена
Сроки регистрации медицинского изделия определяется регламентом ЕАЭС (представлены на схеме). Проверка изделия экспертами и сбор необходимой документации не входят в этот срок. Срок во многом зависит от быстроты реагирования производителя на запросы экспертов ООО «Юниверсал Право», испытательных центров и Росздравнадзора.
На стоимость регистрации влияет несколько факторов:
— Размер государственной пошлины;
— Стоимость необходимых испытаний;
— Готовность документации к экспертизе.
Размер госпошлины за выдачу регистрационного удостоверения в ЕАЭС фиксирован и составляет 11 тысяч рублей.
Государственная пошлина за проведение экспертизы безопасности, качества и эффективности медицинского изделия обуславливается классом риска, к которому принадлежит конкретное изделие. Она составляет:
— 72 тысяч рублей для изделий 1 класса;
— 104 тысяч рублей для изделий 2а класса;
— 136 тысяч рублей для изделий 2б класса;
— 184 тысяч рублей для изделий 3 класса.
Услуги нашей компании
Мы предлагаем клиентам полный спектр услуг, требуемых для успешной регистрации медицинских товаров и последующей их продажи. Наша компания успешно осуществляет:
— проверку и корректировку готовых сопроводительных документов;
— разработку досье на медицинские изделия;
— помощь при прохождении испытаний;
— подготовку документов, требуемых для начала процедур;
— консультации и помощь на всех этапах регистрации.
Мы также предлагаем удобное комплексное сопровождение регистрации медицинских изделий. В ходе такой услуги мы оформляем все требуемые документы и заключения, свидетельствующие о качестве и надёжности продукции нашего заявителя. От заказчика не требуется никаких дополнительных действий, кроме предоставления нам некоторых базовых документов и образцов своей продукции.
Вы можете заказать не только комплексную услугу, но и обратиться к нам за единичной консультацией или помощью на конкретном этапе регистрации, который вызывает у вас наибольшую сложность. Это может быть, как подготовка базового пакета документов на начальном этапе, так и помощь при получении самого регистрационного удостоверения в самом конце процедуры.